做IF时,如何选择固定剂和通透剂
1. 固定剂的选择
在拿到样本之后,很重要的一步就是要对细胞进行固定。固定,顾名思义就是将细胞“固定”起来,这样能长久的保持细胞形态和抗原状态,让抗原能够与抗体更充分且更稳定地结合。固定剂在这个环节发挥着重要作用,它会影响蛋白(抗原)的亚细胞定位实验结果。
比如,我们研究部分核蛋白时发现如果采用乙醇固定,就会出现胞浆染色的结果。
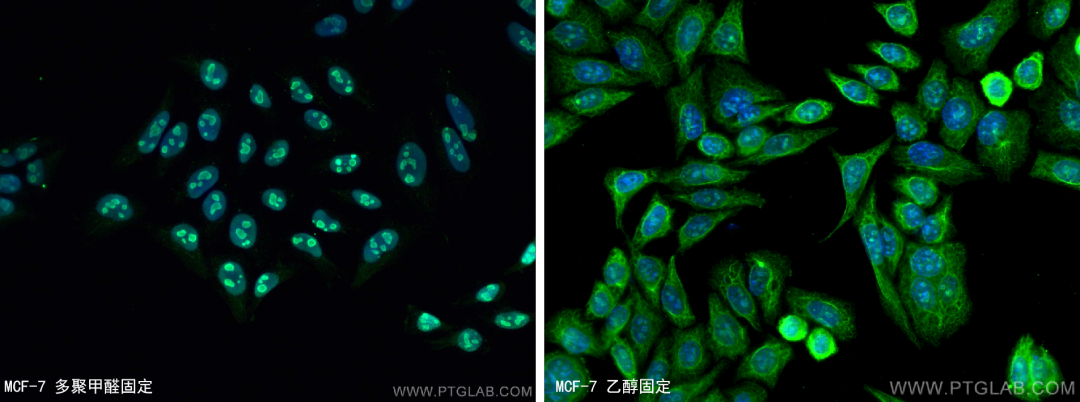
B23/NPM1抗体(货号:60096-1-Ig)染MCF-7细胞
左图4%多聚甲醛固定MCF-7细胞(细胞核着色-阳性),右图乙醇固定(细胞质着色-非特异性着色)。
而当我们用E-cadherin抗体染细胞膜时,如果采用的是4%多聚甲醛固定,也会出现细胞核假阳性信号。
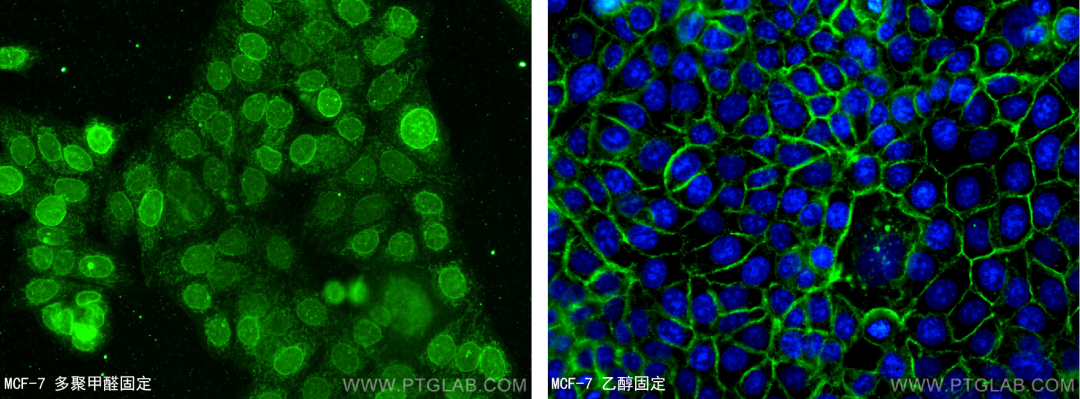
E-cadherin抗体(货号:20874-1-AP)为细胞膜着色
左图4%多聚甲醛固定MCF-7细胞(细胞核着色-非特异性着色),右图乙醇固定(细胞膜着色-阳性)。
显然,固定剂确实影响到蛋白(抗原)的亚细胞定位实验结果。不同固定剂的作用原理不同,不同靶蛋白及所用抗体特性不同,都可能影响到固定剂使用效果。因此选对合适的固定剂对一个准确可靠的IF结果是至关重要的。
上面与预期结果不一致是因为采用了乙醇固定才导致了非特异性着色结果,前人的研究中均采用的4%多聚甲醛固定。
那么该如何挑选合适的固定剂呢?
常用的固定剂种类很多,一般固定剂可分为两大类:可溶性溶剂和交联剂。可溶性溶剂比如丙酮、乙醇等能去除脂类物质并使细胞脱水,把蛋白质沉淀在细胞结构上。交联剂比如多聚甲醛可以通过自由氨基基团把生物分子桥连起来,形成一个相互连接的抗原网。
组织或细胞经过固定后可使胞内蛋白凝固,减少或终止外源性酶和内源性酶的反应;保持组织或细胞的抗原性,避免抗原发生弥散;保持组织和细胞的固有形态和结构。
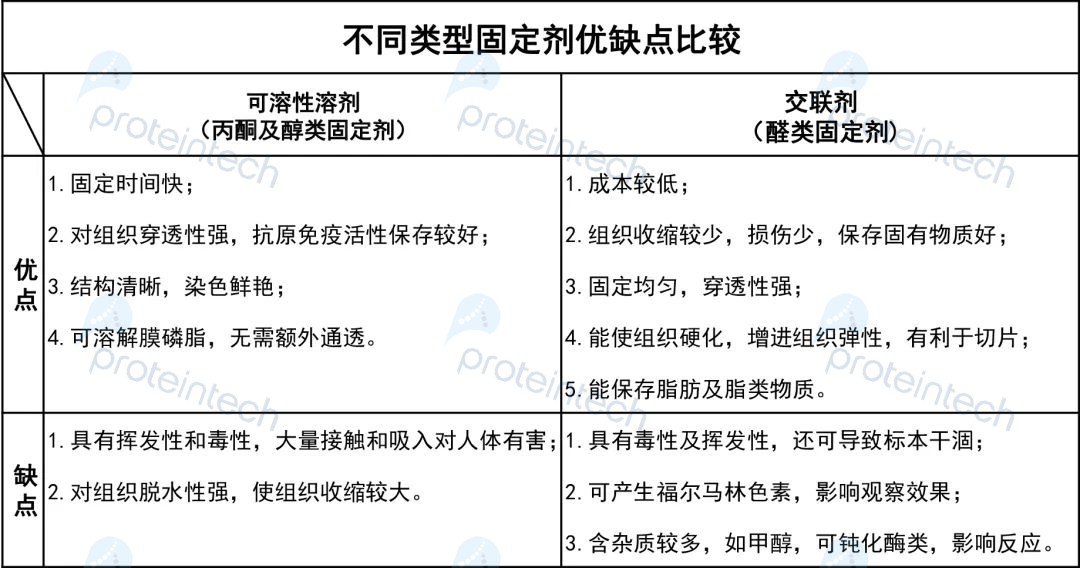
不同类型固定剂优缺点如下:
根据多年抗体开发和蛋白检测经验,Proteintech总结了一份【不同细胞器首选固定剂方法】,供大家参考:
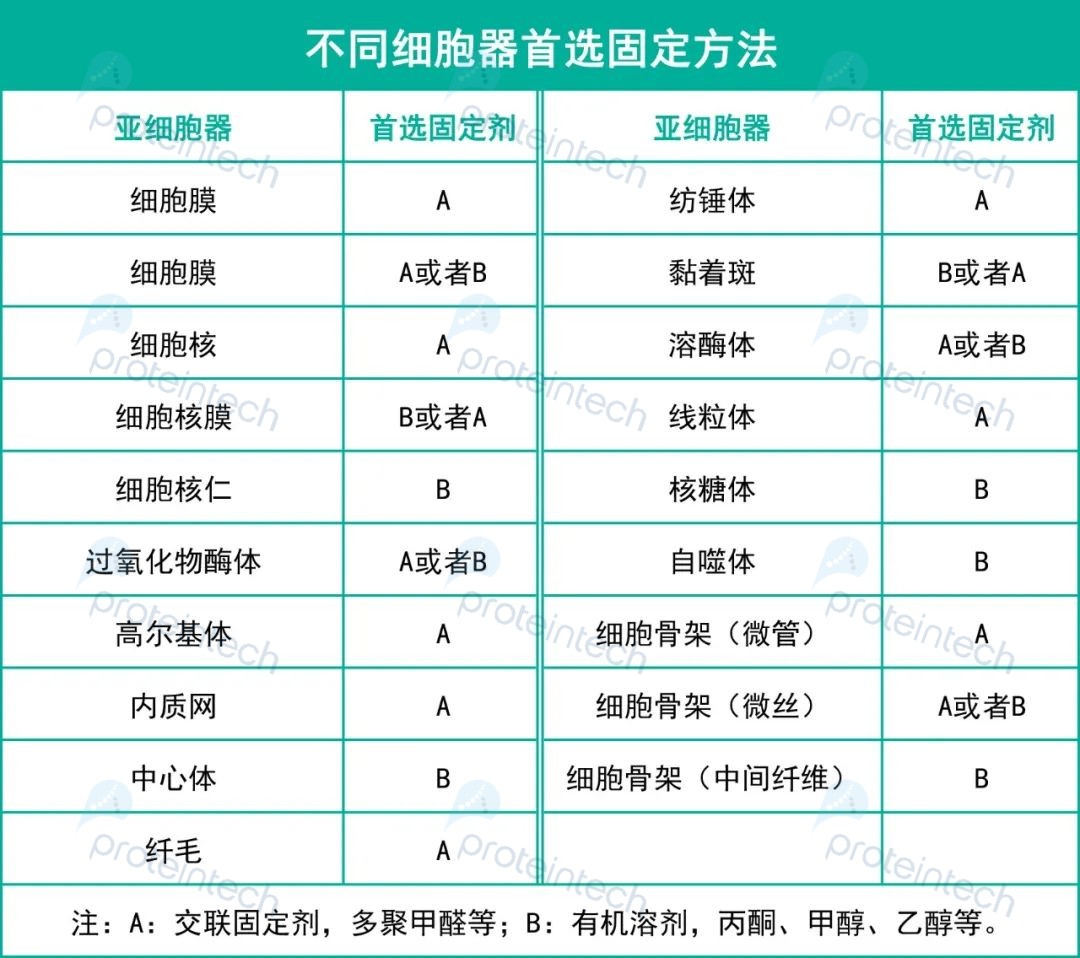
当然,固定剂的选择其实是没有通用规则的,以上表格也是经验之谈,不排除有特殊情况。如果没有达到预期的实验效果,您也可以尝试更换其他固定试剂。
2. 通透剂的选择
通透剂没选好同样会造成IF结果不理想。
交联固定剂比有机溶剂能更完整的保持细胞结构,保存脂类物质,但也会因此而阻碍抗体-抗原的结合,甚至屏蔽抗原表位,造成阴性检测结果。因此可能需要增加一个通透步骤以使抗体能够顺利进入并接触抗原。我们可以根据靶标所处的位置进行选择使用或者不使用通透剂,以及选择何种强度的通透剂。

1)如果您检测的是胞外表位(细胞膜表面蛋白、膜整合蛋白的胞外段等),则无需进行通透,固定之后即可检测。
2)如果您检测的是胞内表位(膜整合蛋白的胞内段、细胞骨架蛋白、细胞器膜外蛋白等),需选择温和的细胞通透剂,比如Digitonin、Leucoperm、Saponin和Tween 20等,它能够在膜上打孔,增加细胞膜的通透性,使抗体进入胞质中,识别胞质中的表位。
3)如果您检测的是有膜细胞器内的表位(核内蛋白、线粒体内的蛋白等),则需要采用强通透剂,比如Triton X-100和NP-40等,它们可以部分溶解细胞核膜等细胞器膜结构,使抗体进入细胞器内部识别抗原并结合抗原表位。
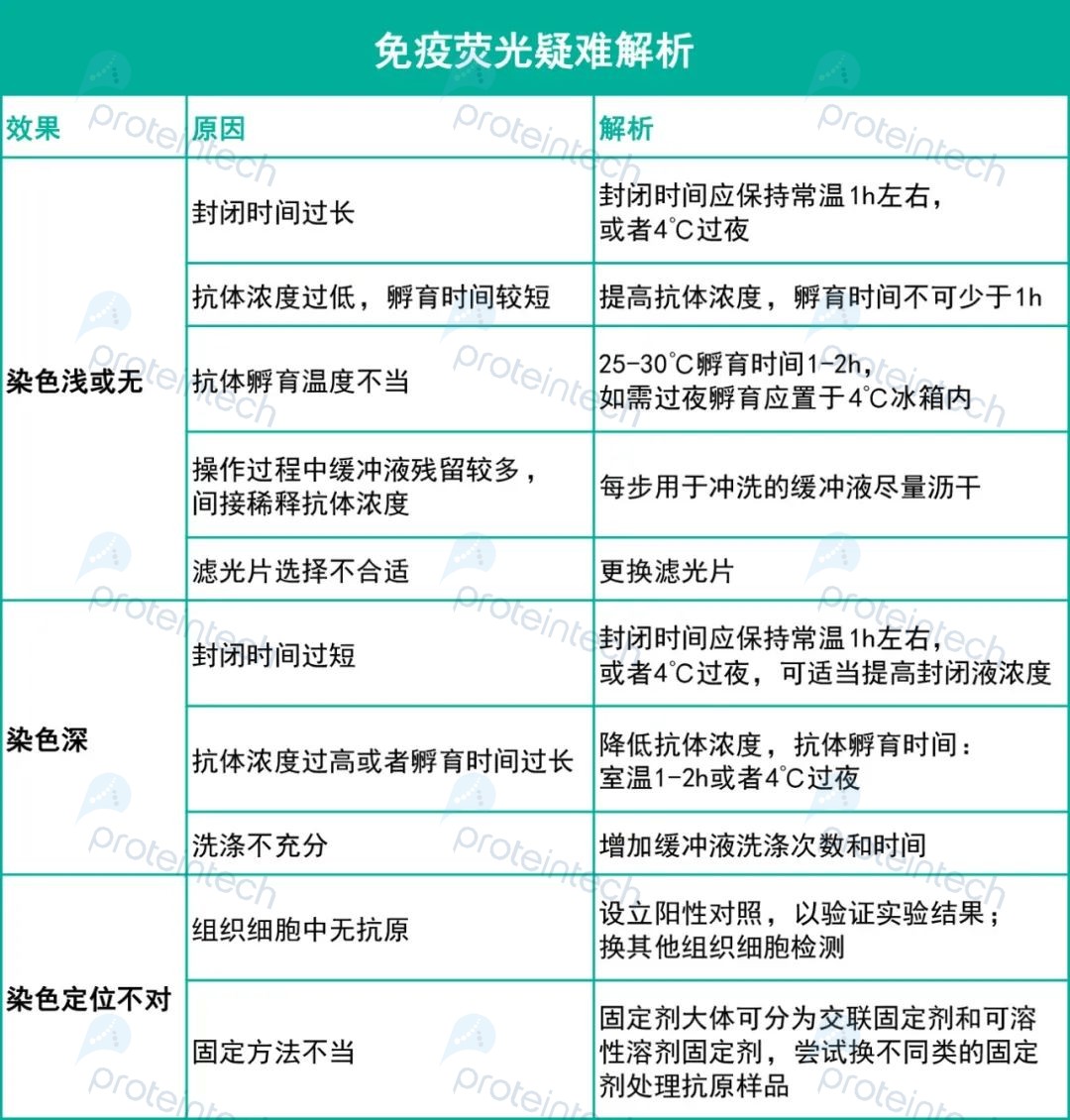
3. 其他注意要点
免疫荧光结果不理想,可能的原因非常多,其中固定剂和通透剂的选择是至关重要的一步!
除此之外的可能原因,我们总结了一份【免疫荧光疑难解析】,针对各种不理想情况做了相应的分析!