蛋白提取要点详解
高级研发经理的10年心得
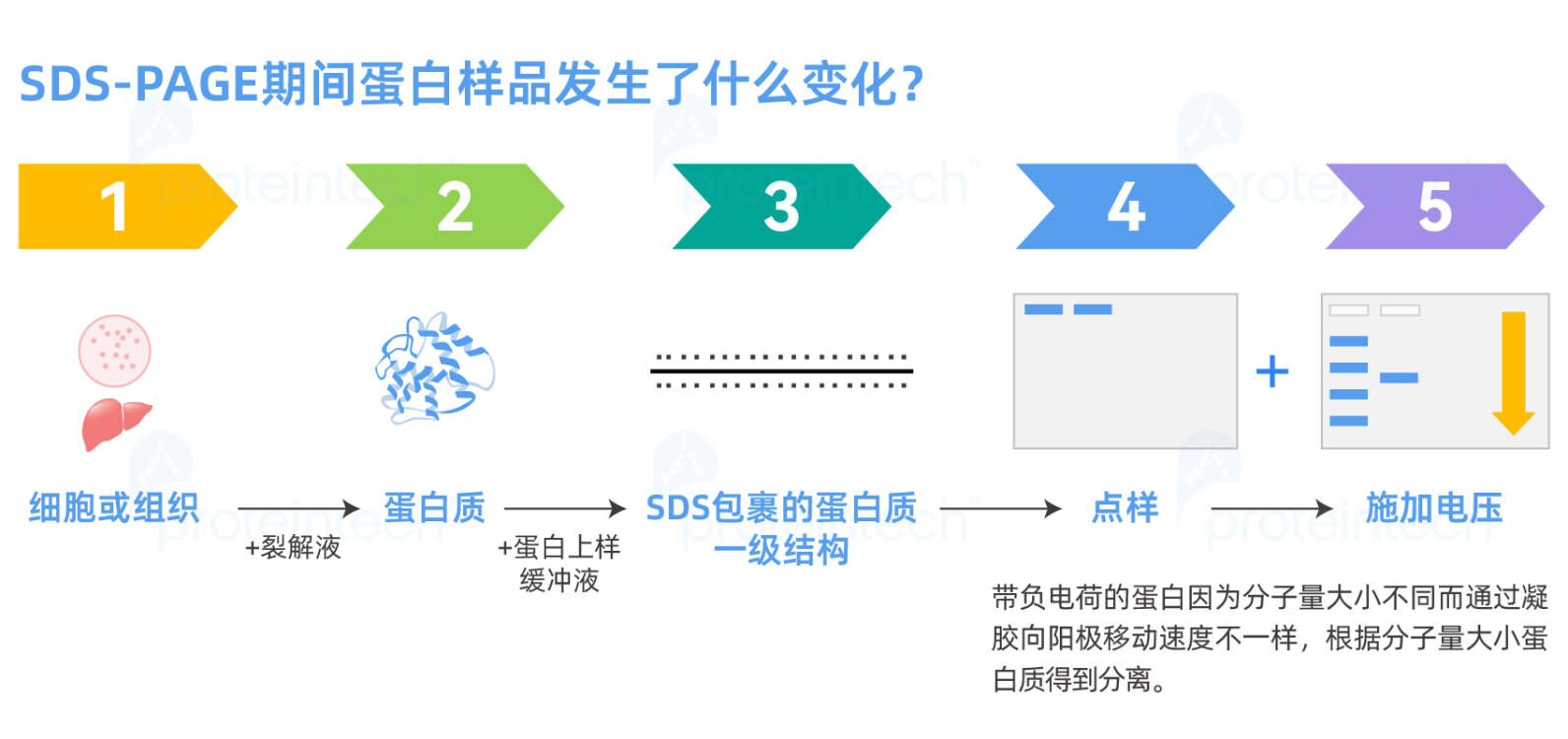
免疫印迹是用于蛋白质分析的常规技术,通过在电场的作用下将电泳分离的蛋白从凝胶转移至一种固相支持物,然后利用抗原-抗体的特异性反应,从蛋白混合物中检测出目标蛋白,从而定量或定性的确定正常或实验条件下细胞或组织中目标蛋白的表达情况。蛋白提取成功,是Western Blot成功的首要前提,下面我们针对蛋白提取的每一个步骤的原理和操作重难点进行详细讲解!
原理
完整的细胞(组织也是由细胞构成)经过裂解液的处理,膜结构被打开,细胞中的各类蛋白质被释放出来(包含我们的目的蛋白质),此时的蛋白质是具有完整的四级空间结构和蛋白活性。
紧接着我们通过加入含有SDS和还原剂的蛋白上样缓冲液煮样,目的蛋白质的空间结构解离变性展开,SDS与蛋白质结合形成蛋白质-SDS复合物。由于SDS带有大量负电荷,复合物所带的负电荷远远超过蛋白质原有的电荷,这使得不同蛋白质间电荷的差异被掩盖。
在SDS-PAGE体系中带负电荷的蛋白,因为分子量大小不同而通过凝胶向阳极移动速度不一样,最终根据分子量大小蛋白质得到分离。
WB样品制备所需试剂
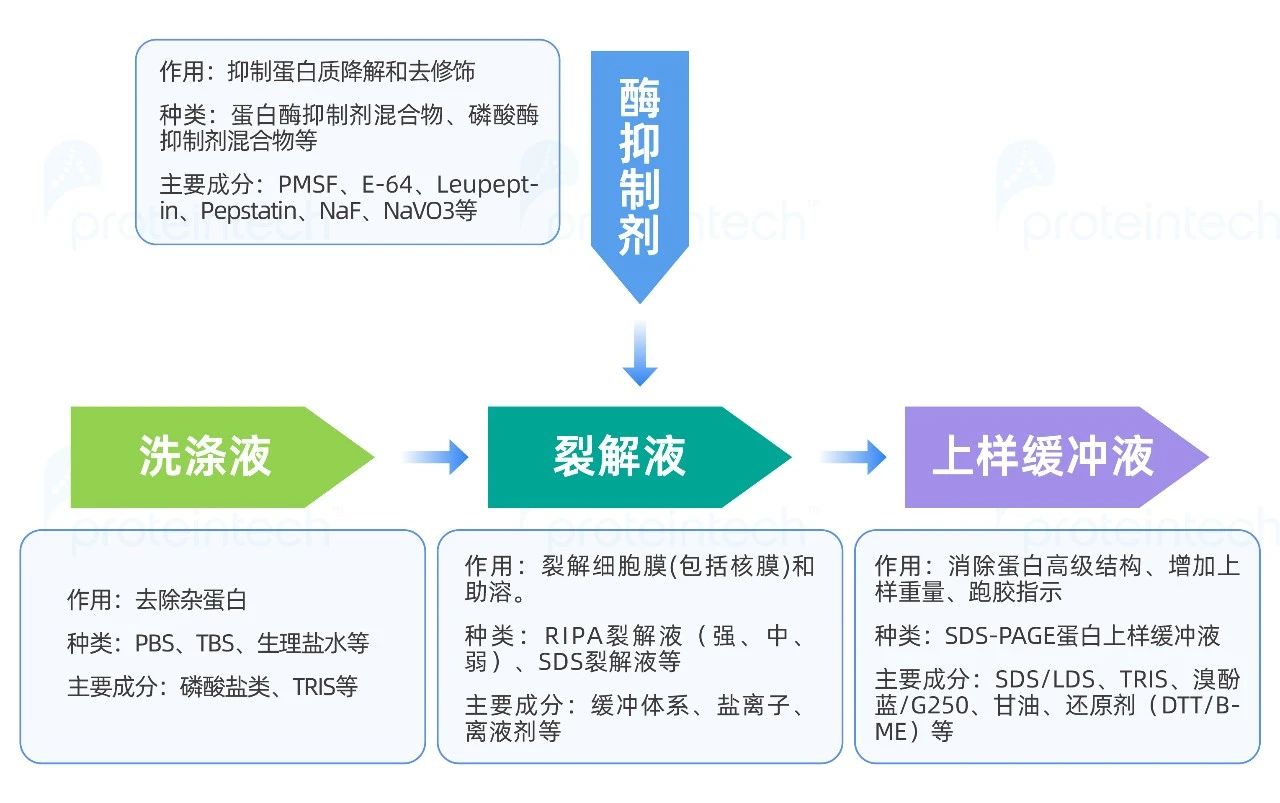
通过上述原理的回顾,就能很清楚的知道我们在整个WB样品制备中需要洗涤液、裂解液、酶抑制剂和上样缓冲液四类常用试剂,那它们各自有哪些组分及功能呢?
1. 洗涤液
我们在裂解细胞或组织之前,清洗的步骤必不可少,它的主要作用是去除干扰样品的杂蛋白,包括培养细胞时添加的牛血清、培养基及组织中的血液和脂肪等,我们常用的洗涤液有PBS、TBS、生理盐水等,可长期储存在4-8℃冰箱,方便每次使用时维持着低温状态。
2. 裂解液
清洗干净的细胞或组织需借助裂解液的溶解能力打开膜结构,释放出所有的蛋白质(包含我们需要的目的蛋白)。裂解液主要成分包含缓冲体系、盐离子、离液剂等。
1)缓冲系统
裂解pH过高或过低都可能使蛋白质变性析出或水解,因此通常采用近似生理pH 7.4和20-50 mmol/L离子强度来作缓冲体系。
Tris-HCl缓冲液因其缓冲能力强,不容易与其它离子形成不溶物,且与整个电泳系统兼容性好,因此是裂解的首选缓冲液。除此以外,也有用HEPES或其它缓冲液的。
需要注意的是,制样体系中尽量避免高浓度钾离子,因为高浓度钾离子可与SDS形成沉淀(如下图)。

2)盐离子
通常大家习惯于以生理盐浓度作为裂解液的盐离子浓度,即150mM NaCl。
在提胞浆蛋白等易溶组分时,也有借助低盐而实现低渗,从而使细胞胀破以实现质膜分离的,这种情况下一般使用不超过50mM的NaCl。
当盐离子浓度过高时,部分蛋白可能会因盐析而出现沉淀。此外,过高的离子浓度会导致泳道内局部电流过大,最终跑出笑脸状条带。即使有少数蛋白可能需要高盐提取的,或借助盐析除去干扰蛋白的,但最终的样品需调回生理盐浓度。

3)离液剂
离液剂是一类可以弱化蛋白质疏水性的试剂,常用的离液剂有两类:
第一类是通过断裂蛋白质内的分子间的氢键,使蛋白分子去折叠,从而破坏了蛋白质分子的空间结构,如尿素或硫脲类。此类裂解液裂解能力强,提取的蛋白质大多数已经属于变性状态,只推荐用于Western Blot实验。
第二类是表面活性剂,也称为去垢剂。其通过疏水性尾部与蛋白质疏水部分结合,亲水性头部暴露在液体环境,来实现助溶作用。此类离液剂相对较为温和,能够保持蛋白质的活性,可用于Western Blot、IP、Co-IP、ELISA等验。
特别注意:高浓度的阴离子表面活性剂除外,SDS还作为变性剂和助溶试剂,它能断裂分子内的分子间的氢键,使 蛋 白分子去折叠,从而破坏了蛋白质分子的空间结构。
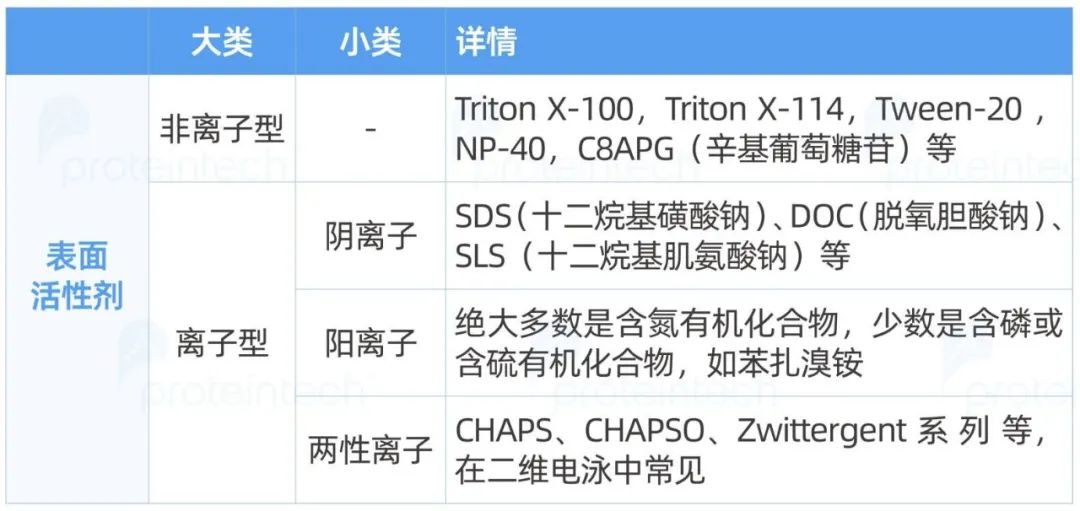
根据溶解于水后是否能电离出离子,表面活性剂又可以分为离子型表面活性剂和非离子型表面活性剂。离子型表面活性剂又可按照电离后疏水部带电电荷性质分为阴离子表面活性剂、阳离子表面活性剂和两性离子表面活性剂。
常见的表面活性剂如下表:
需要注意的是:在整个SDS-PAGE系统中,有一个很关键的核心思想,就是借助SDS使蛋白带上等比例的负电荷,使得蛋白的泳动速度仅与其分子量相关,因此阳离子表面活性剂一般不用于提取蛋白,否则可能出现蛋白反着跑的情况,喜欢创新的童鞋尤其要注意这一点。
虽然上面列举了多种表面活性剂,但对于一个特定的蛋白质该优先使用何种表面活性剂目前没有发现有固定的规律,也没有相应的理论作为支持。因此,当常规的裂解液无法有效地提取到目的蛋白时,则可能需要自行尝试不同的表面活性剂的提取效率。尤其对于一些难溶的膜蛋白,建议大家参考文章报道的裂解液或原理类似的裂解液。
小P也根据长期的实验经验,针对不同样本进行裂解液选择推荐:

3. 酶抑制剂
组织或细胞内通常含有大量的蛋白酶,在提取过程中这些蛋白酶被释放出来,有可能剪切目的蛋白。因此,抑制住这些蛋白酶的活性对于防止目的蛋白的降解极有帮助。
常见的蛋白酶抑制剂有:PMSF、抑肽酶、Leupeptin、Pepstatin、AEBSF-HCL。
PMSF对多种不同活性中心的蛋白酶都有极好的抑制作用,而且效率高,因此基本是必加的试剂。但是需要注意的是PMSF是主要针对丝氨酸蛋白酶和巯基蛋白酶的抑制剂,如果我们仅使用PMSF太过于单一,不能全方位的保护我们的目的蛋白。同时PMSF在水溶液中不稳定,半衰期很短(pH=7时为110分钟,pH=8时为35分钟),我们使用时需要及时补加。
此外,由于许多蛋白酶都需要二价金属离子才具有活性,因此常见的金属离子螯合剂也常常被用于抑制蛋白酶活性,如EDTA-2Na、EGTA-2Na等。
另外,做磷酸化蛋白的Western blot时,还需要加入磷酸酶抑制剂,避免磷酸化形式的蛋白发生去磷酸化,这类抑制剂有氟化钠、原矾酸钠、焦磷酸钠和β-甘油磷酸钠。其中原矾酸钠需要经过激活才有效地发挥抑制作用(调pH至10左右,然后加热至无色,冷却后再调pH至10,如此反复至稳定即可)。
重点提示:检测磷酸化蛋白务必同时添加蛋白酶抑制剂和磷酸酶抑制剂,且蛋白酶抑制剂和磷酸酶抑制剂均需在裂解前提前加入至裂解液中。

4. 蛋白上样缓冲液
接着我们需要借助蛋白上样缓冲液,将目的蛋白质的空间结构解离变性展开。蛋白上样缓冲液主要包含缓冲体系、变性剂、甘油、还原剂、指示剂。
1)变性剂
蛋白上样缓冲液中常用的变性剂有SDS和LDS,其主要作用为解离蛋白质之间的氢键,消除多肽折叠,将蛋白质的空间结构解离变性展开,变性剂包裹在蛋白质一级结构表面,去蛋白质自身电荷使其带负电荷的。
通常在1×蛋白上样缓冲液中加2%-4% SDS/LDS。SDS常用于Tris-甘氨酸胶体系,LDS用于Bis-Tris和Tris-乙酸胶体系居多。
相比于SDS,LDS通常认为不仅具有SDS相同的变性能力,还更加利于维持蛋白质的完整性。
2)甘油
起到增加样品比重的作用。1×的使用浓度通常在5%-15%之间调整,如小分子蛋白样品制备可以适当调整甘油浓度至10-12%,常规分子量7-10%。
3)还原剂
许多蛋白天然条件下存在二硫键而形成多个分子的聚合体,另有少数蛋白在制样的过程中也会自发形成二硫键。在裂解液中引入还原剂可以有效地还原二硫键,使得提取的蛋白都以单体形式存在。
常见的还原剂有DTT(二硫苏糖醇)和BME(beta-巯基乙醇)。在蛋白制备中这两种还原剂效果相差不大。但需要注意的是DTT易被氧化,BME易挥发,二者都不稳定,最佳为现用现加。
此外,市面上大多为即用型的蛋白上样缓冲液,为了维持最佳的使用效果,尽量避免过多的反复冻融,可以适当分装使用,使用时间太久时(如半年以上)可适当的补加还原剂以维持最佳效果。
4)指示剂
跑胶过程中起到指示作用。常用的指示剂有溴酚蓝、考马斯亮蓝G-250、酚红等。
需要注意:不同的指示剂由于其自身所带的电荷及分子结构差异并不能完全代表着最下沿蛋白分子的位置,即使是 同 一种指示剂在不同胶浓度、胶体系中所指示的位置也是有差异的。
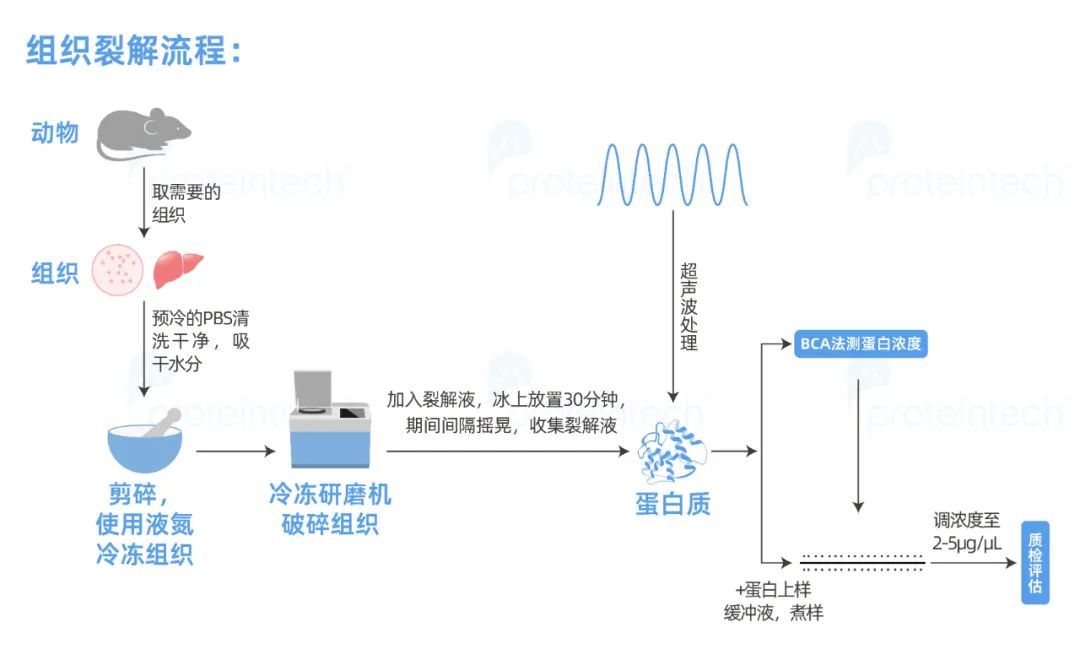
裂解流程
通过上述理论讲解,想必各位聪明的童鞋一定完全GET了WB制样原理。下面小P带着大家一起突破WB制样操作的重难点!
1. 细胞裂解
细胞样品的制备成功与否首先需有良好生长状态的细胞,同时我们需要选择合适的细胞裂解方式。
优先推荐选用瓶内裂解法,其最大的优点是可以有效的防止细胞在离心过程中破碎,能有效的提高总蛋白得率,同时也能完整的保留细胞外基质(ECM)。
悬浮细胞、贴壁不牢和药物处理过的细胞选用离心法,不推荐使用胰酶消化法。

2. 组织裂解
组织裂解的关键同样在于组织本身的完整状态,因此在取样阶段就需规划好取样顺序,防止样品降解。
取样顺序:最先取胃肠道消化系统相关组织,接着取肺(巨噬细胞含量高)、肝脏(蛋白种类多)、膀胱、生殖系统相关的组织(睾丸、卵巢、子宫、输卵管等),最后取心脏、脾脏、肾脏、骨骼肌、大小脑等组织。胃肠道消化系统相关组织推荐现取现制备。组织样本如需保存,可将采集的组织样本液氮速冻,然后转移至-80℃保存。
对于血液含量丰富的组织样本如:心脏、肝脏、脾脏、肺、肾脏等组织,剪碎后使用冰的PBS洗涤液清洗2-3遍(可以适当按压排出血液),直至样本血红色变浅,滤纸吸干水分称重,防止后续因内源IgG产生干扰。
对于脂肪含量丰富的组织样本,预先把样本放在几层纸巾上按压,去除部分脂类,然后再使用冰的PBS清洗1-2遍,滤 纸吸干水分称重。
清洗干净的组织可以借助液氮研磨或冷冻研磨机完成研磨。组织样品研磨完成之后,后续大致的步骤与细胞样品处理类似。与细胞样品不同的是,组织内经常富含结缔组织,有些在常规裂解液中难以溶解,因此不溶物通常比细胞样品多。
关键点
1. 防降解
前面已提到,一些组织和细胞内经常含有蛋白酶,在提取蛋白的过程中,有可能对目的蛋白内源性剪切,总体上可以从以下几个方面来避免蛋白被降解:

1)尽量采用新鲜样品制样,尤其是含蛋白酶丰富的消化系统(胃肠道等)、生殖系统(睾丸、卵巢等)、腺状体(胰腺、胸腺等)、肺、肝脏、斑马鱼及一些巨噬细胞类、淋巴细胞类、单核细胞类等样品。
2)提取蛋白时,避开蛋白酶的最适活性温度。对于常见的哺乳动物组织或细胞的蛋白样品的制备过程中,所有的步骤都可在低温下完成,所有的试剂都需预冷,以降低蛋白酶活性,防止蛋白降解。
3)加快提取速度。对于组织来说,取样顺序最先取消化系统相关的组织(如胃、大小肠、肝脏、胰腺等)和富含巨噬细胞的组织(如肺),然后取生殖相关的组织(如卵巢、子宫、睾丸等),最后取心、肝、脾、肾、脑等器官。取下的组织冻存在液氮或-80度冰箱里。少数细胞系,如单核/巨噬细胞类等,也含较多蛋白酶,在提取时也需要快速提取,在不影响提取效果的前提下,可考虑用高浓度SDS等强烈的裂解液以缩短裂解时间。
4)如前所述,使用蛋白酶抑制剂抑制细胞或组织中释放的蛋白酶活性尤为重要,尤其是商业化的蛋白酶抑制剂混合物具有很好的抑制效果。考虑到部分蛋白酶抑制剂组分(如PMSF)在水溶液中不稳定,半衰期很短,我们可在实验中及时补加新鲜的蛋白酶抑制剂以提高抑制效果。
5)不要使用胰蛋白酶消化。胰蛋白酶消化细胞同时会剪切一些对胰酶敏感的蛋白,从而在WB检测时经常可以检测到消化出来的短片段而误以为是杂带如下图:

2. 防杂质干扰
在蛋白提取中经常可能会混入一些杂质,后期影响电泳分离效果,常见杂质有:

1)外来蛋白杂质
在提取蛋白时尽可能使用洁净器具,防止样本被污染。一些反复用的器具如匀浆器、研磨杵等需保持干净。
尤其不建议用蛋白酶消化细胞或组织,而达到裂解的目的。
除此以外,整个实验过程中穿戴手套、口罩、头套、穿实验服等防护装备,来避免唾液、头皮屑、角质层等外源性蛋白的干扰。
2)核酸或脂类
核酸和脂都可能与蛋白质结合。如果制备的样品中含有大量的脂类或核酸,则有可能使目的蛋白泳动速率拖慢,或者可能形成大的复合物而不能进入浓缩胶。
核酸通常可以通过超声方法打断成小片段,使其不能形成完整的蛋白质结合结构域,而最终与蛋白分开。有创新的童鞋可能会选用核酸剪切酶酶切核酸,但是这种方式也是不推荐的,如同胰蛋白酶,核酸剪切酶同样可能会剪切一些对其敏感的蛋白。
脂类则在获取组织时尽量避开,在制样后可将样品放置低温,有部份油脂可能漂浮在液面上,只需用枪吸取弃之即可,如仍不能有效去除,可以考虑二氧化硅吸附之。
3)盐离子
前面已述,高浓度的盐离子可能会使泳道内电流过大,而引起笑脸条带。另外,如果泳道间离子浓度不等,则可能出现不同泳道的同一蛋白分子量表现有高有低。因此,在制样过程中尽量控制离子浓度不要过高,各样品之间离子浓度不能有大太差异。
3. 蛋白定量
样品提取完成后需进行蛋白定量,以确保上样量清楚可控。
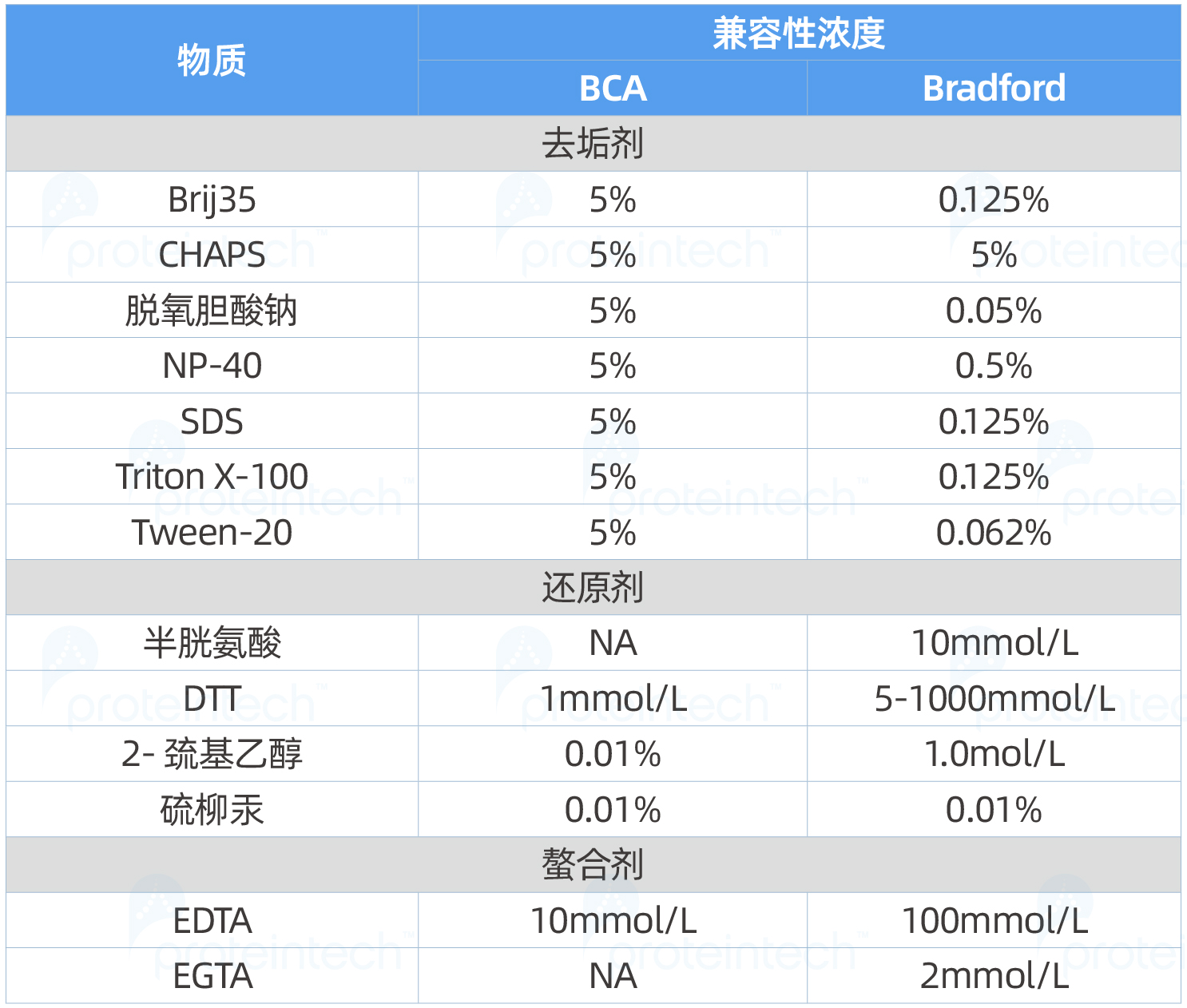
考虑到大多数WB蛋白样品中均含有高浓度的去垢剂,推荐首选兼容去垢剂浓度更高的BCA蛋白浓度检测试剂盒。
但需要注意的是还原剂、螯合剂、强酸及强碱等会干扰BCA定量分析,即使浓度很低也可能会影响定量的结果(见下表)。可通过BCA浓度检测之后,再加入还原剂和螯合剂或稀释待测样品的方式,将干扰物质的浓度降至可兼容的范围以内。
为了保证每道的上样量一致,经常需要将高浓度的样品调低,或将低浓度的样本浓缩。调低样本浓度一般可直接用1*Loading buffer稀释,浓缩样本则建议进行超滤操作,以保证操作前后离子浓度变化不大。但需要注意的是请勿直接在凝胶孔中调浓度,这样容易出现“哑铃”状条带。
4. 特殊提取方法
有些蛋白只在特定的细胞或特定的细胞器中,以较低丰度分布。如果只提总蛋白,很可能达不到Western blot检测下限。因此可能需要分离特定的细胞类群或细胞器。
另前面已述,有少数蛋白在常规裂解液中不易溶解,可能需要特殊的手段才能提取,尤其是一些多次跨膜的蛋白或是核内蛋白,建议也参考文献方法提取或者购买对应的蛋白提取试剂盒操作。

5. 样品评估
样品制备完成后是否就可以直接使用了呢?
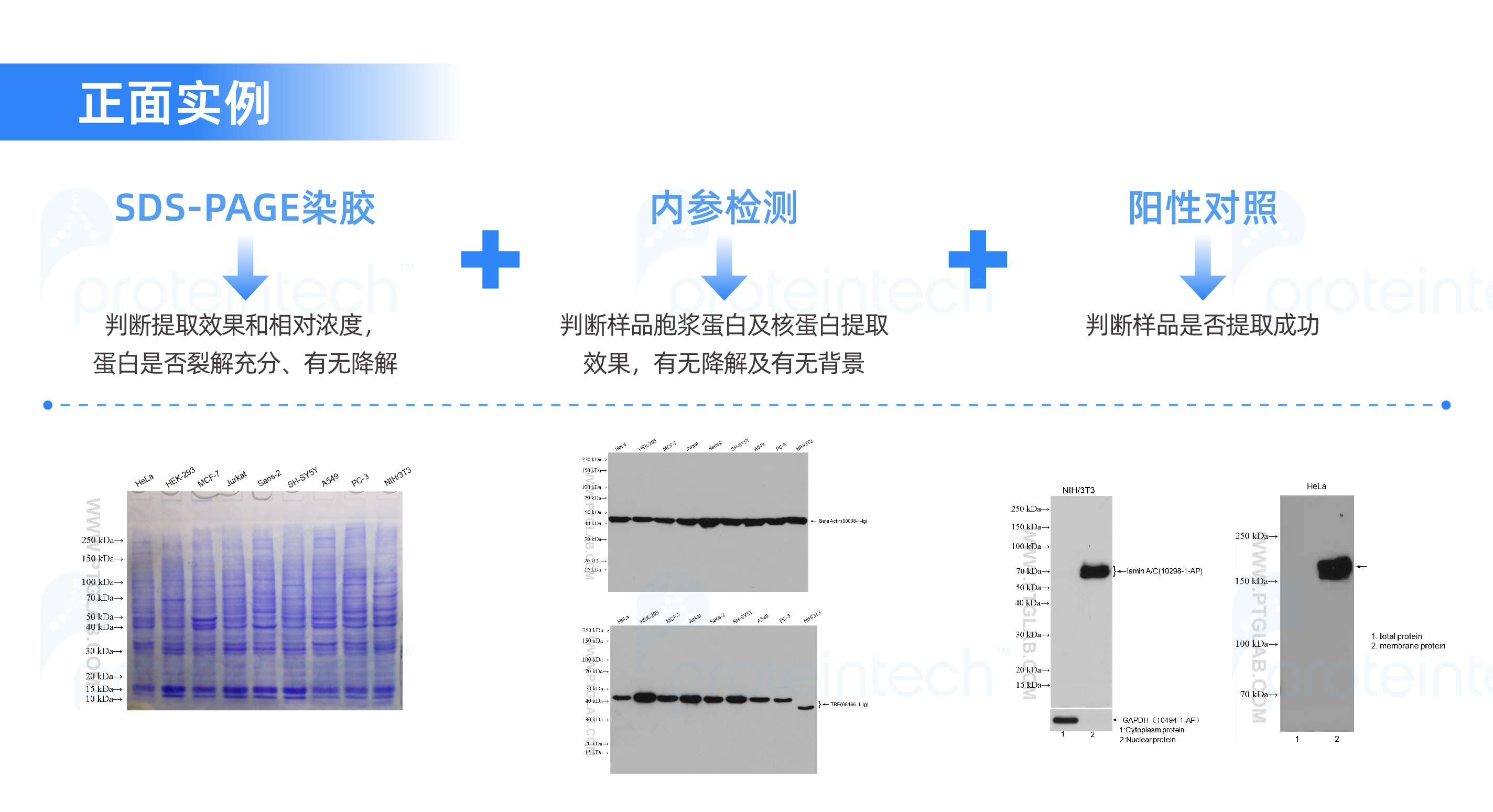
出于严谨的角度,我们可以通过SDS-PAGE染胶、内参检测、阳性对照等实验大致判断提取效果和相对浓度,以及蛋白是否裂解充分、有无降解,见下图:
再来看一组失败的例子:

在这组失败的例子中我们可以发现,SDS-PAGE染胶对于样品的评估是非常有参考价值的。裂解不充分、降解、核酸未打断等问题都能非常明显的评估出来,可以作为我们样品评估的最基本检测。
另外血液污染的问题,也需要引起关注,尤其是做药理分析的童鞋们,样本的种属最好和抗体的种属源不交叉,如小鼠的组织样品最好选用非小鼠源的抗体(如兔源),这样可以有效的避免内源性IgG干扰。
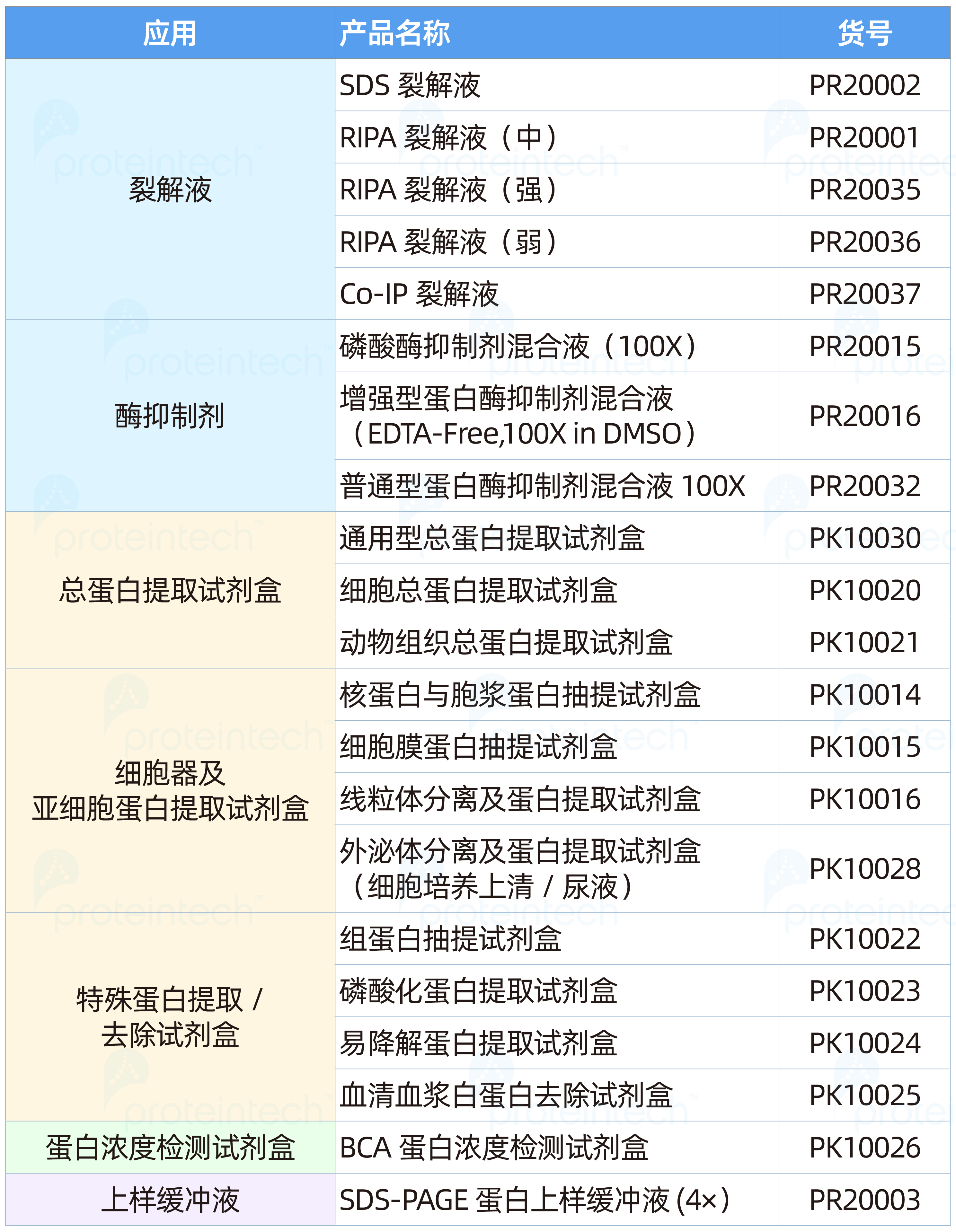
相关产品推荐
“工欲善其事,必先利其器”,我们也可以通过Proteintech提供的专业样品提取试剂及试剂盒,真正实现让样品提取如同吃饭、睡觉一样简单!
具体目录见下表: