Validation Data Gallery
Product Information
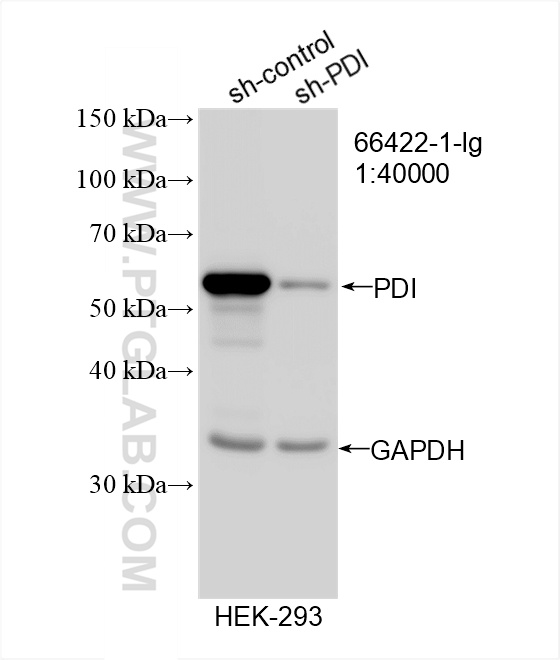
本产品是以pLVX-sh-zsGreen-Puro为载体质粒构建的PDI sh-RNA表达质粒,经蛋白表达水平验证,确认为有效PDI sh-RNA表达质粒。
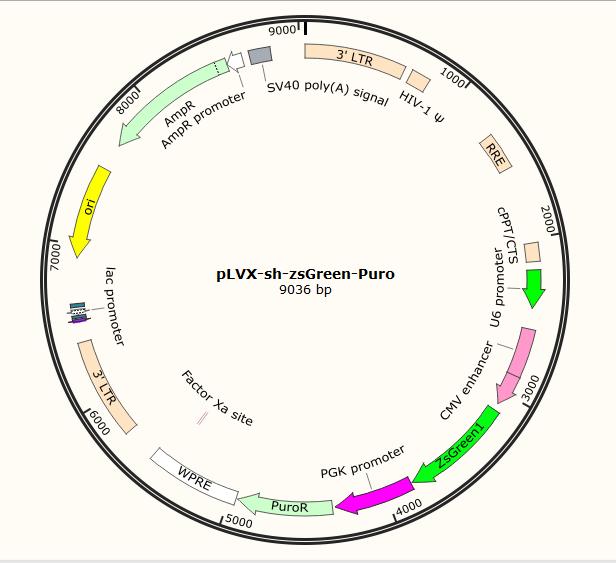
载体信息
载体名称 | pLVX-sh-zsGreen-Puro |
质粒类型 | 慢病毒表达载体;shRNA表达载体;三启动子载体 |
克隆方法 | 多克隆位点,限制性内切酶 |
启动子 | U6;PGK;CMV |
5' 测序引物及序列 | U6:GACTATCATATGCTTACCGT |
载体抗性 | 氨苄青霉素(Ampicillin) |
筛选标记 | 嘌呤霉素、zsGreen |
克隆菌株 | E.coli cells(RecA-)推荐: Stbl2,OmniMAX 2 T1R |
宿主细胞(系) | 哺乳动物细胞 |
备注 | pLVX-sh-zsGreen-Puro慢病毒表达载体是基于HIV的慢病毒载体; |
稳定性 | 稳表达 |
组成型/诱导型 | 组成型 |
病毒/非病毒 | 慢病毒(HIV) |
保存条件
-20℃保存 ,有效期12个月。
使用方法
慢病毒包装
1. 提前将需要转染的质粒准备好(包装质粒PSPAX2和PMD2.G)。
2. 转染前一天铺好293T细胞。确保转染时293T细胞密度达到70%-90%。
3. 转染时包装质粒PSPAX2和PMD2.G按质量比2:1混合,命名mix-1。以一个六孔板的孔为例,转染体系:
HEPES缓冲液:100 uL
mix-1:2 ug
shRNA-plasmid:2 ug
转染试剂(如PEI等):6 uL
室温静置30 min,然后均匀的加入到293T细胞里面,轻轻摇晃六孔板,最后放入37℃培养箱。
4. 转染完6h之后给293T细胞换新鲜完全培养基。
慢病毒感染靶细胞
1. 转染24h后准备需要的感染的靶细胞的种类和数量,要求细胞密度在转染48h时达到50%-60%。
2. 转染48h后收取含慢病毒培养上清感染靶细胞(慢病毒感染细胞要在生物安全柜中进行操作):
① 将polybrene加入到新鲜的培养基中,使polybrene终浓度为8 ug/mL,配成混合液。
② 取出293T细胞,将慢病毒上清收集到2 mL的冻存管中,4000 rpm,1 min离心。
③ 将靶细胞中原有的培养基去除,然后加入1 mL的慢病毒和1 mL的混合液。轻轻摇晃六孔板,混匀。
④ 感染18h后进行细胞换液,去除原有的培养基,换上新鲜的培养液。
⑤ 感染48h后进行检测或Puromycin药物筛选细胞。
注意事项
1. 慢病毒操作时最好使用生物安全柜(BL-2 级别),如使用普通超净工作台操作病毒,一定要关闭风机。
2. 慢病毒操作时必须穿实验服,带口罩和手套,尽量不要裸露双手及手臂的皮肤。
3. 操作慢病毒时必须特别小心,不要产生气雾或飞溅。如果操作时超净工作台有病毒污染,立即用10%次氯酸钠溶液(或70%乙醇加1%的SDS溶液)擦拭干净。接触过病毒的枪头、离心管、培养板、培养液于 10%次氯酸钠溶液内浸泡1h以上后弃去。
4. 如需要离心,应使用密封性好的离心管。
5. 慢病毒操作完毕后,脱掉手套,用肥皂和水清洗双手。