免疫荧光(IF)技术指南
一、实验原理
免疫荧光(Immunofuorescence, IF)的主要原理是利用抗原抗体之间的特异性结合来标记目的蛋白,主要包括直接法和间接法。直接法是目的蛋白和带有荧光基团的一抗结合,间接法是目的蛋白和一抗结合,然后一抗再与带有荧光基团的二抗结合,通过荧光显微镜可观测到荧光,进而观测到目的蛋白。

二、操作步骤
01样本处理
细胞爬片
1,在培养板中将已爬好细胞的玻片用PBS浸洗3次,每次3min.
2.在4%多聚甲醛或其他固定液常温固定20min, PBS洗三次,每次3min(固定方法不唯一,具体可参考后续“细胞固定”部分)。
3.在0.2% Triton X-100室温通透5min, PBS洗三次,每次3min。
冰冻切片
1,冰冻切片室温平衡10-20min。
2.在4%多聚甲醛常温固定20min, PBS洗三次,每次3min
3.在0.2% Triton X-100室温通透5min, PBS洗三次,每次3min.
石蜡切片
1.脱蜡
a. 在二甲苯Ⅰ号缸中浸泡20min;
b. 在二甲苯Ⅱ号缸中浸泡20min;
c. 在无水乙醇Ⅰ号缸中浸泡5min;
d. 在无水乙醇Ⅱ号缸中浸泡5min;
e. 在95%乙醇中浸泡5min;
f. 在80%乙醇中浸泡5min;
g. 在60%乙醇中浸泡5min;
h. 用去离子水浸洗3遍,每遍1min。
此处 I 号和 II 号缸是指不同的容器,但是内容物一致。
2.抗原修复
取适量的柠檬酸钠修复液(pH 6.0)或Tris-EDTA修复液(pH 9.0)于烧杯中(修复液能没过切片架即可),盖上盖子,待修复液煮沸后,将切片放入其中,盖上盖子,继续煮沸修复液15min。通风厨中自然冷却。
02细胞固定
固定剂大体可分为两大类:有机溶剂和交联剂。有机溶剂如丙酮和乙醇能去除脂类物质使细胞脱水,把蛋白质沉淀在细胞结构上。交联剂一般通过自由氨基基团把生物分子桥连起来,形成一个相互连接的抗原网。
为在细胞免疫荧光实验固定过程中最大限度地减少固定剂对抗原和细胞结构的破坏,使免疫荧光反应清晰可靠。根据Proteintech多年经验,针对不同细胞器采用的首选固定方法见下表:
| 细胞结构 | 首选固定剂 |
| 细胞膜 | A或者B |
| 细胞质 | A或者B |
| 细胞核 | A |
| 细胞核膜 | B |
| 细胞核仁 | B |
| 高尔基体 | A |
| 内质网 | A |
| 纤毛 | A |
| 中心体 | B |
| 纺锤体 | A |
| 溶酶体 | B |
| 线粒体 | A |
| 核糖体 | B |
| 细胞骨架 | A或者B |
| 自噬体 | B |
注:A:交联固定剂,多聚甲醛等;B:可溶性溶剂,丙酮、乙醇等。固定剂的选择没有通用规则,倘若没有达到预期结果,可更换另一种固定剂尝试。
03抗体孵育及荧光观察
1.将固定好的样片置于装有PBS的培养皿中清洗3次,每次5 min。每次清洗后要用吸水纸将多余的液体吸去,再在下一培养皿中清洗,注意不要干片。
2.封闭:将样片置于干燥的培养皿内,滴加3% BSA-PBS将样片完全覆没放于湿盒中,室温1h或者4℃过夜。
3.用吸水纸将多余BSA-PBS溶液吸去,注意不要干片。
4.在样片上滴加50-100μl稀释后的一抗(参照抗体说明书的推荐稀释比),将完全浸没于一抗的样片室温孵育2h或4℃过夜。
5.用PBS清洗样片,洗涤3次,每次5min。
6.在样片上滴加50-100μl标记有荧光素的稀释后的二抗(参照抗体说明书的推荐稀释比),将完全浸没于二抗的样片放于湿盒中室温孵育1h(避光)或4℃过夜。
7.用PBS清洗样片,洗涤3次,每次5min。
8.在样片上滴加50-100μl的DAPI-PBS(1μg/ml),完全浸没于DAPI的样片放于湿盒中室温孵育5-10min(避光)。
9.用PBS清洗样片,洗涤2次,每次5min。
10.滴加封片剂,确定样品在盖玻片与载玻片之间。
11.用荧光显微镜观察。根据不同的染料选择不同波段的激发光。
三、疑难解析
免疫荧光实验结果不理想,一般可能会出现以下三种问题:
1、组织细胞无着色
组织细胞无着色,一种情况是实验操作问题,包括实验操作不当、实验材料异常、抗体选择和抗体质量问题等,这些均可通过设置阳性对照以及阴性对照实验来排除。
第二种情况是蛋白表达问题,同上期讲的“WB实验无条带”一样,IF实验准备阶段也需要查阅大量资料,初步确认目的蛋白的时空表达谱(包含表达量、表达部位、刺激条件等)。
以ACTA2蛋白为例:2019年4月,有客户反馈ACTA2抗体(货号:14395-1-AP,Proteintech)检测c57小鼠心肌组织无荧光反应。后经技术支持复检发现,ACTA2蛋白主要表达于血管平滑肌细胞(该抗体“Background”中有明确提示)。

复检结果也与预期一致:

14395-1-AP ,mouse heart tissue
2、染色定位不对
染色定位“不对”,可能是你的预期不对。同样需要确认目的蛋白的时空表达谱。
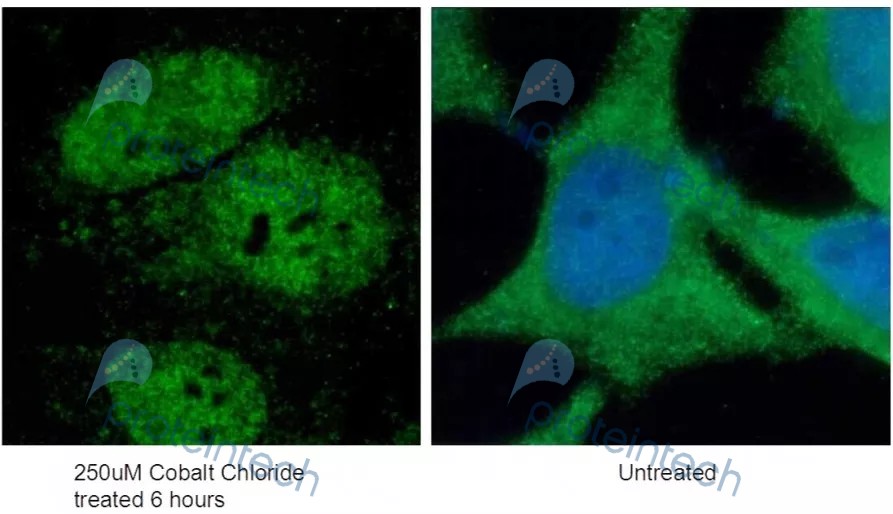
以HIF1a蛋白为例:首先,通过UniProt网站,咱们了解到HIF1a蛋白在正常情况下为胞浆定位,但是在缺氧条件下,会向核内转移。
随后以CoCl2(一种化学性低氧模拟剂)处理模拟低氧环境,以HIF1a抗体(货号:20960-1-AP,Proteintech)通过IF实验检测。结果发现:未处理前,HIF1a蛋白定位于胞浆;处理后,HIF1a蛋白在核内聚集。
其次,染色定位不对,还有可能是固定剂惹的祸。
在“蛋白“不安分”,原来是固定剂惹得祸!”推文中有详细介绍,此处不再赘述。
3、染色过浅/过深
对于染色过浅或者过深,我们首先应该感到欣慰,毕竟初步实验结果与预期一致,接下来需要做的就只是优化实验条件了。
染色过浅,可能由于 a)封闭时间过长,b)抗体浓度过低,c)抗体孵育温度不当或时间过短,d)操作过程中缓冲液残留过多,间接稀释抗体浓度;
染色过深,可能由于 a)封闭时间过短,b)抗体浓度过高,c)抗体孵育时间过长,d)洗涤不充分(洗涤次数少或时间短),e)滤光片选择不合适。
针对出现的结果,可以根据以上几条依次排除并优化实验条件。对于Proteintech出品的抗体,推荐封闭时间常温1h左右,4℃过夜;抗体孵育时间常温不少于1h,4℃过夜;洗涤3次,每次5min。
总之,对于免疫荧光实验而言,要想实验结果漂亮,首先需要在实验前做好充足准备,了解目的蛋白详细信息,确定最合适的组织细胞材料;其次在细胞固定阶段随机应变,选择最适合的固定剂;最后在抗体孵育阶段,要合理微调孵育时间和抗体浓度,以达到最优的实验条件。




