IF实验中怎么去除自发荧光?
免疫荧光实验基于抗体技术,通过利用多种荧光基团标记单一或是多个靶标,轻轻松松就能实现蛋白定位及丰度的可视化。好的免疫荧光数据可以让文章立马就变得很“出彩”。就像这样:


图源客户数据
为什么做三色四色都能清晰明了,而有时做个最简单的双色,杂信号比目标信号还强呢?
1. 什么是自发荧光?
自发荧光是指在荧光检测过程中产生的与目的信号无关的背景荧光信号。该背景荧光不是抗原-抗体-荧光团相互作用的特异性着色,而是由很多其他原因引起,比如:
1.1 交联固定诱导自发荧光
实验中,我们常用于组织固定的方法是化学交联剂,例如福尔马林、戊二醛等。这些固定剂通过与蛋白质之间共价结合作用,将细胞组织结构固定为形态稳定的不溶性网状物。在这固定过程中,醛会与胺结合形成席夫碱,导致自发荧光(戊二醛>多聚甲醛>甲醛,PMID:6404984)。这种因交联剂固定产生的自发荧光具有广泛发射光谱,在蓝色,绿色和红色光谱范围内均可检测到信号。

(图源文献:J Trop Med, Dec. 2016, Vol.16, No.12)
1.2 内源性物质自发荧光
此外,由于组织中的存在多类天然化合物,也会发生自发荧光。
比如红细胞中的血红素基团,由于其卟啉环结构而呈现红色自发荧光(PMID:29058770);胶原蛋白发射波长在300-450nm左右的蓝光区域(PMID:11830520);NADH是许多新陈代谢所必需的酶,在代谢活跃的细胞和组织(例如肝脏)中含量增加,发射波长约为450nm(PMID:11830520);脂褐素是一种颗粒状的亲脂性色素,随着年龄增长会在骨骼肌,神经元和心脏等许多组织细胞中聚集,在500-695nm处发光最强烈。除此之外还有核黄素、弹性蛋白等也是产生自发荧光的大户。
2. 如何消除自发荧光?
不管是交联固定诱导的自发荧光、还是内源性物质的自发荧光,对于实验而言,都是杂信号,会对我们的检测结果造成干扰和误判。因此我们需要去除这些背景荧光,降低信噪比。
相对于冷冻切片而言,石蜡切片自发荧光现象尤为严重。因此我们在进行石蜡切片免疫荧光实验时,首先要确保严格去除切片上的石蜡残留,然后再针对以上情况我们各个击破。
1)由于醛类固定导致的自发荧光,我们可以尝试采用其他固定方式,比如甲醛固定改为-20℃乙醇固定,可有效降低交联固定而诱导的自发荧光。
此外,还可采用硼氢化钠处理,硼氢化钠作为还原剂,可还原C=C和C=N键,从而减少自发荧光;不过硼氢化物在中性 pH 环境下不稳定,实验重复性较低(PMID:9765122)。
2)在胎盘、心脏、肝脏、脾脏等组织,会有大量红细胞(血红素)产生的自发荧光,我们可以在组织固定之前,先用PBS灌注组织,洗去大量红细胞,从而降低血红素自发荧光干扰;遗憾的是,某些组织样本(胚胎组织等)PBS灌注难以实现。
部分研究显示,在某些情况下还可通过低pH下用CuSO4和NH4Cl处理或直接用H2O2漂白组织来实现自发荧光消除。
3)由脂褐素产生的自发荧光,我们可以通过苏丹黑B处理,苏丹黑B具有疏水性,而脂褐素颗粒是由溶酶体消化的脂质残基组成,故苏丹黑B能有效结合富含脂质的脂褐素颗粒而掩盖其自发荧光(PMID:10330448)。
不过苏丹黑B会在远红光通道中发出荧光,因此在进行多重染色时须考虑到这一点。
4)除以上手段外,我们还可以根据体系中可能存在自发荧光的发射光波长来挑选合适的荧光基团标记,自发荧光和目标荧光信号波长相差大,更易于区分和过滤掉背景荧光。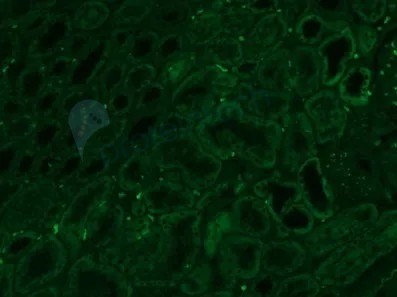
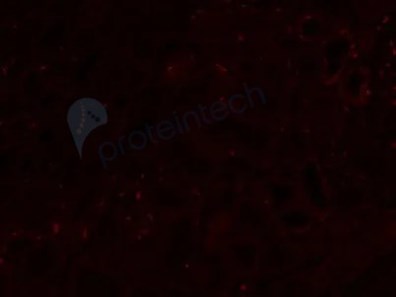
未染色肾组织FFPE样本,左边为绿光通道,右边为远红光通道,远红光通道背景低,选择荧光基团时可优先考虑。
5)不少文献显示,市面上存在着一些自发荧光消除试剂盒,如TrueVIEW(VectorLabs)可以有效消除组织切片中由于醛固定、红细胞以及胶原蛋白/弹性蛋白结构造成的自发荧光。
6)最后,不管是选择什么方法,不管是针对什么组织,进行免疫荧光检测实验时,我们始终要添加内源性组织对照(无一抗或二抗)和一抗对照(仅二抗),以在实验中揭示自发荧光水平和非特异性结合。



